اصول شیمی مدرنویرایش
مادهویرایش
نوشتار اصلی: ماده
ماده بهطور کلی تمام آن چیزی است که اشیاء فیزیکی شامل آن میشوند. تا پیش از سدهٔ بیستم میلادی، اصطلاح ماده شامل مادهٔ معمولی تشکیل شده از اتمها بود و دیگر پدیدههای انرژی مانند نوریا صدا را در بر نمیگرفت. این مفهوم از ماده، اکنون به هر گونه چیزی که دارای جرم، حتی در حالت س، گسترش یافته ولی این تعریفها نارسا است زیرا جرم یک شیء خود میتواند در نتیجهٔ حرکت و تعامل انرژیهای (احتمالاً بدون جرم) بوجود آید. همهٔ چیزهایی را که در زندگی روزمره میتوانیم لمس کنیم از اتمها تشکیل شدهاند. این مادههای ساخته شده از اتمها، که آنها هم به نوبهٔ خود از تعامل ذرات زیراتمی شکل گرفتهاند معمولاً از یک هسته، محتوی پروتون و نوترون، و ابری از الکترون در مدار پیرامون هسته ساخته شدهاند.
ذرات بدون جرم، مانند فوتونها، ماده در نظر گرفته نمیشوند، چرا که آنها نه جرم و نه حجم دارند. با این حال، تمام ذرات با جرم هم، دارای حجم (به معنی کلاسیک) نیستند، زیرا ذرات بنیادی مانندکوارکها و لپتونها (که گاهی اوقات با ماده برابرند) ذراتی نقطهای» در نظر گرفته شدهاند که اندازه و حجم مؤثری ندارند. با این وجود، کوارکها و لپتونها با هم ماده معمولی» را تشکیل میدهند، و اثر متقابل آنهاست که به ایجاد حجم مؤثر در ذرات مرکب که ماده معمولی را میسازند کمک میکند.[۵][۶]
اتمویرایش
نوشتار اصلی: اتم
اتم (به یونانی: Άτομο به معنی ناگسستنی (تجزیه ناپذیر)») کوچکترین واحد تشکیل دهنده یک مادهٔ ساده است که میتواند به کمک پیوند شیمیایی به اتمی دیگر متصل گردد.[۷] تئوری مکتب اتم گرایی که از عقیدهٔ تشکیل مواد از ریزدانههای نادیدنی (در برابر عقیده به تفکیکپذیر بودن مواد به ذرات نامتناهی) دفاع میکرد از تاریخ باستان شناخته شده بود.
ابتدا توسط هوشتانه (به یونانی اوستن یا اوستانوس) که در لشگرکشی خشایارشا به یونان با او همراه بود و در آنجا به آموزش کیمیا میپرداخت طرح گردید.[۸] مکتب آموزشی او چنان مورد استقبال قرار گرفت که بنا به گفتهٔ پلینی(پلینیوس)، بسیاری از فیلسوفان یونان همچون فیثاغورث، امپدکلس، دموکریت، وافلاطون برای مطالعهٔ آن به خارج سفر کردند.[۹][۱۰] پس از او توسط فلاسفهٔ یونان باستان از جمله لئوکیپوس و شاگرد وی دموکریت و همچنین بعدها در هند و در یکی از شش مدرسهٔ هندوئیسم یعنیوایشِشیکا که توسط کاناد بنیان نهاده شده بود، تدریس میشد.
اتم از یک هسته مرکزی با بار مثبت محاطه شده با ابر الکترونی با بار منفی تشکیل شدهاست. تعریف دیگری آن را به عنوان کوچکترین واحدی در نظر میگیرد که ماده را میتوان به آن تقسیم کرد بدون اینکه اجزاء بارداری از آن خارج شود.[۱۱] اتم ابری الکترونی، تشکیلشده از الکترونها با بار الکتریکی منفی، که هستهٔ اتم را احاطه کردهاست. هسته نیز خود از پروتون که دارای بار مثبت است ونوترون که از لحاظ الکتریکی خنثی است تشکیل شدهاست. زمانی که تعداد پروتونها و الکترونهای اتم با هم برابر هستند اتم از نظر الکتریکی در حالت خنثی یا متعادل قرار دارد در غیر این صورت آن را یون مینامند که میتواند دارای بار الکتریکی مثبت یا منفی باشد. اتمها با توجه به تعداد پروتونها و نوترونهای آنها طبقهبندی میشوند. تعداد پروتونهای اتم مشخصکننده نوع عنصر شیمیایی و تعداد نوترونها مشخصکننده ایزوتوپ عنصر است.[۱۲]
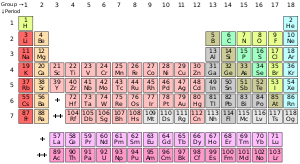
عنصرویرایش
نوشتار اصلی: عنصر
فرم استاندارد جدول جدول تناوبی عناصر شیمیایی. رنگها نشان دهنده دستههای مختلف عناصر هستند
عنصر در دانش شیمی به مادهای گفته میشود که اتمهای آن تعدادپروتونهای برابر در هستهی خود داشته باشند. این عدد (تعداد پروتونها) که با نماد Z نشان داده میشود، عدد اتمی آن عنصر نام دارد. همه اتمهایی که دارای تعداد پروتونهای برابر (عدد اتمی برابر) باشند، ویژگیهای شیمیایی یکسانی دارند. اما اتمهای یک عنصر میتوانند دارای تعداد متفاوتی نوترون باشند که ایزوتوپهای آن عنصر نامیده میشوند. گاهی نیز برای سادگی، به عنصر شیمیایی صرفاً عنصر گفته میشود. ویژگیهای شیمیایی اتمهای یک عنصر توسط ساختار الکترونی آنها تعیین میشود که آن نیز به تعداد پروتونهای هسته آن اتم وابسته است.
عناصر شیمیایی میتوانند در هنگام واکنش شیمیایی با یکدیگر ترکیب شده و تعداد بیشماری ماده شیمیایی بوجود آورند. مثلاً آب نتیجه واکنش عنصرهای هیدروژن و اکسیژن است. در این حالت، دواتم هیدروژن و یک اتم اکسیژن به هم متصل میشوند و مولکولی بافرمول شیمیایی H2O میسازند. همین دو عنصر در شرایط متفاوت میتوانند مادهٔ دیگری را به نام هیدروژن پراکسید (آب اکسیژنه) بسازند که دارای مولکولهای H2O2 است. به همین شکل، همهترکیبهای شیمیایی میتوانند به عناصر سازنده خود تجزیه شوند. به عنوان مثال میتوان آب را به کمک برقکافت به عناصر هیدروژن و اکسیژن تبدیل کرد.
نماد عناصر چهارگانه در یونان باستان
یک ماده خالص که تنها از اتمهای یک عنصر تشکیل شده باشد، ماده ساده» نامیده میشود. چنین مادهای را نمیتوان به ماده دیگری تجزیه کرد. از این دیدگاه، ماده ساده در برابر ماده مرکب قرار میگیرد. به عنوان مثال، اکسیژن یک عنصر است. اما مادهای را که ما در طبیعت به عنوان گاز اکسیژن شناختهایم، در حقیقت یک ماده ساده دو اتمی از این عنصر است که دی اکسیژن» یا اکسیژن مولکولی» (O2) نامیده میشود. اوزون شکل دیگری از عنصر اکسیژن است که در طبیعت با فرمول (O3) یافت میشود. رابطه بین دی اکسیژن و اوزون رابطهای است که به آن دگرشکلی(آلوتروپی) میگویند. به زبان دیگر، دی اکسیژن و اوزون، دگرشکلهای عنصر اکسیژن هستند. الماس و گرافیت نیز دو آلوتروپ برای عنصر کربن هستند. عناصر دیگر مانند گوگرد و فسفر هم دارای آلوتروپهای شناختهشدهٔ پرکاربردی هستند.
عناصر شیمیایی را نمیتوان به کمک واکنشهای شیمیایی معمولی به یکدیگر تبدیل کرد. تنها واکنشی که میتوان با استفاده از آن تعداد پروتونهای هسته اتمهای یک عنصر را تغییر داد و یک عنصر را به عنصر دیگری تبدیل کرد، یک واکنش هستهای است که آن را واکنشتبدیل هستهای مینامند.
تا کنون ۱۱۸ عنصر، کشف یا ساخته شدهاند. از این تعداد، ۹۴ عنصر در طبیعت یافت میشوند و بقیه بهطور مصنوعی و به کمک واکنشهای هستهای در آزمایشگاه ساخته شدهاند. از میان همه عناصر، ۸۰ عنصر دارای حداقل یک ایزوتوپ پایدار میباشند که به جز عنصر شماره ۴۳ (تکنسیم) و عنصر شماره ۶۱ (پرومتیم) همگی دارای عدد اتمی برابر یا پایینتر از ۸۲ هستند. به زبان دیگر در جدول تناوبی تنها عناصری که از عنصر ۸۳ (بیسموت) سبکتر بوده و دارای ایزوتوپ پایدار نمیباشند، تکنسیم و پرومتیم هستند.
ترکیبویرایش
نوشتار اصلی: ترکیب شیمیایی
کربن دیاکسید (CO2)یک نمونه از ترکیبات
ترکیب شیمیایی عبارت است از یک ماده شیمیایی خالص که از دو یا چند عنصر شیمیایی مختلف تشکیل میشود. این عناصر به وسیلهٔپیوند شیمیایی به یکدیگر متصل میشوند و میتوانند به وسیلهواکنش شیمیایی به مواد ساده تبدیل گردند. هر ترکیب شیمیایی مختلف، یک ساختمان شیمیایی تعریف شده منحصر به فرد دارد؛ به عبارت دیگر، هر ترکیب نسبت اتمی یکسانی دارد که اتمهای آن با چینش مکانی مشخصی به وسیله پیوند شیمیایی آرایش مییابند. ترکیبات شیمیایی ممکن است به صورت ترکیب مولکولی باشند که در این صورت مولکولها با پیوند کووالانسی در کنار هم قرار میگیرند؛ همچنین ممکن است به صورت نمک باشند و به وسیلهپیوند یونی به هم پیوند یابند؛ اگر ترکیب مورد نظر تنها شامل فاتباشد، پیوند بین ذرههای آن پیوند فی و اگر کمپلکس شیمیاییباشد، پیوند بین ذرات آن پیوند داتیو خواهد بود. عناصر شیمیاییخالص، در گروه ترکیبات شیمیایی قرار نمیگیرند، حتی اگر از دو یا چند اتم از یک نوع عنصر (مانند H۲ و S۸) تشکیل شده باشند که پیوندهای دو اتمی یا چند اتمی نامیده میشوند.
مولکولویرایش
نوشتار اصلی: مولکول
مدل گلوله و میله مولکول کافئین (C8H10N4O2).
فرمول اسکلتی بنزن (C6H6)
مولکول کوچکترین ذرهٔ یک مادهٔ شیمیایی خالص است که ویژگیهای آن ماده را دارد. یک مولکول از دو یا چند اتم تشکیل شده که با پیوند شیمیایی به هم متصلند. البته مولکول بعضی عناصر (همچون گازهای بیاثر) تنها از یک اتم تشکیل شدهاست. اتمهای یک مولکول میتواند از یک نوع یا از چند نوع باشد. نسبت اتمها در یک مولکول خاص همیشه ثابت است. برای مثال در مولکولآب نسبت اتمهای هیدروژن به اکسیژن همیشه ۲ است. تعداد اتمهای موجود در یک مولکول به وسیلهٔ فرمول شیمیایی آن نشان داده میشود. فرمول شیمیایی به تنهایی نشان دهندهٔ ویژگیهای ماده نیست. ممکن است دو ماده فرمول شیمیایی یکسانی داشته باشند، اما ویژگیهای آنها کاملاً متفاوت باشد. برای مثال اتانول و دیمتیل اتر فرمول شیمیایی یکسان اما خواص شیمیایی متفاوت دارند. به این مواد ایزومر گفته میشود.
مول و مقدار موادویرایش
نوشتار اصلی: مول
مول مقداری از هر ماده است که تعداد ذرات بنیادی آن (مولکول یا اتم) برابر با تعداد اتمهای موجود در ۱۲ گرم از کربن-۱۲ است. این تعداد، عدد آووگادرو نامیده شده و برابر است با ۱۰۲۳ × ۶٫۰۲۲۱۴۱۹۹. که در واقع مقداری از جسم که تعداد واحدهای بنیادی آن برابر با عدد آووگادرو باشد، یم مول است که به صورت واحد SI بهشمار میرود.[۱۳]
مواد خالص و مخلوطویرایش
  | |
  | |
  | |
| نمونههایی از مواد شیمیایی خالص از چپ به راست: عناصر قلع (Sn) وگوگرد (S), الماس (به عنوان دگرشکلی از کربن), ساکارز (شکر خالص), و سدیم کلرید (نمک) و بیکربنات سدیم (جوش شیرین), که ترکیبات یونی هستند. |
مواد خالص مادهای است که تنها از یک جزء ساخته شدهاند به عبارت دیگر ماده خالص مادهای است که تنها از یک نوع عنصر یا یک نوع ماده مرکب تشکیل شدهاست.[۱۴] مجموعهای از مواد خالص مواد مخلوط را تشکیل میدهند. هوا و آلیاژها نمونههایی از مخلوطها هستند.[۱۵]
فاز (ماده)ویرایش
نوشتار اصلی: فاز
مثالی از تغییرات فاز
به قسمتی همگن و مشخص از یک ماده که در آن خواص فیزیکی و ساختار شیمیایی به صورت پیوسته (نه گسسته) تغییر کند، فاز گفته میشود. هر فاز توسط مرزهای حقیقی از فازهای مجاور خودش جدا میشود که به ان فصل مشترک میگویند که در این مرزها خواص به صورت گسسته تغییر میکنند.
پیوند شیمیاییویرایش
نوشتار اصلی: پیوند شیمیایی
فرایند پیوند یونی بین سدیم (Na) و کلر (Cl) به شکل سدیم کلریدیا نمک خوراکی. پیوند یونی جاذبه بین یونهای با بار ناهمنام است.
پیوند شیمیایی به نیروهایی که اتمها یا مولکولها را کنار هم نگه میدارد گفته میشود و بر دو دستهاند: پیوندهای میان اتمی: شامل پیوند کووالانسی - پیوند الکترووالانسی (پیوند یونی) - پیوند فیو پیوندهای میان مولکولی: نیروی واندروالسی - پیوند هیدروژنی
این پیوندها میتواند بین دو اتم یکسان یا دو اتم متفاوت باشد که در حالت اول آن را مولکول جور هسته و در حالت دوم آن را مولکول ناجور هسته مینامند. استحکام پیوند شیمیایی را الکترونگاتیوی (یا الکترونگاتیویته) تعیین میکند. تعداد پیوندهای شیمیایی در مولکولهای مختلف متفاوت است و از یک پیوند در مولکولهای سادهٔ دو اتمی تا پیوندهای بسیار در ماکرومولکولها را شامل میشود.[۱۶][۱۷]
انرژیویرایش
نوشتار اصلی: انرژی
انرژی خاصیتی از جسم است که قابل انتقال به اشیای دیگر یا قابل تبدیل به حالتها و شکلهای مختلف است. انرژی کمیتی بنیادین است که برای توصیف وضعیت یک ذره، شیئ یا سامانه به آن نسبت داده میشود. گونههای متفاوتی از انرژی شناخته شده و به دستههای متفاوتی طبقهبندی میشوند از آن جمله میتوان انرژی جنبشی، انرژی پتانسیل، انرژی گرمایی، انرژی الکترومغناطیسی،انرژی شیمیایی و انرژی الکتریکی و انرژی هستهای را نام برد. بجزانرژی هستهای منبع همه گونه انرژیهایی که بشر از آن استفاده میکند خورشید است.
واکنش شیمیاییویرایش
نوشتار اصلی: واکنش شیمیایی
واکنش ترمایت با استفاده از اکسید آهن (III).
واکنش شیمیایی فرایندی است که در آن ساختار ذرههای تشکیل دهندهٔ مواد اولیه دچار تغییر میشود؛ یعنی طی آن یک یا چند ماده شیمیایی به یک یا چند ماده شیمیایی دیگر تبدیل میشود. تغییراتی که در واکنشی بر روی مواد واکنشدهنده صورت میگیرد، بطور کلی به دو نوع تغییرات فیزیکی و شیمیایی تقسیم میشوند. در تغییرات شیمیایی اتصال اتمها به یکدیگر و آرایش الکترونی آنها در واکنشدهندهها تغییر مییابد. البته در یک واکنش شیمیایی، اتمها نه بهوجود میآیند و نه از بین میروند و تنها ترکیب، تجزیه یابازآرایی میشوند. واکنش شیمیایی بیان یک تغییر شیمیایی است که ممکن است با آزاد کردن انرژی به صورت گرما، نور یا صوتهمراه باشند و تولید گاز، تشکیل رسوب یا تغییر رنگ در پی داشته باشند.
یونها و نمکهاویرایش
نوشتار اصلی: یون
ساختار شبکه بلوری ترکیب سدیم کلرید(NaCl) که نمونهای از یک ترکیب یونی است. در این نگاره گوی ارغوانی رنگ نمایانگرکاتیونهای سدیم (Na+) و گوی سبز نشاندهندهٔ آنیونهای کلرید (Cl−)
یون به اتم یا مولکولهایی گفته میشود که بار الکتریکی اضافه داشته باشند و این بار میتواند منفی یا مثبت باشد. نابرابری تعداد کل الکترونها با پروتونها، در یک اتم یا مولکول، به آن بار خالص مثبت یا بار خالص منفی الکتریکی میدهد. با استفاده از روشهایفیزیکی یا شیمیایی، از طریق یونیزاسیون میتوان این پدیده را ایجاد کرد. از نگاه شیمیایی، اگر یک اتم خنثی، یک یا چند الکترون خود را از دست دهد، دارای بار خالص مثبت میشود و به عنوان یککاتیون شناخته میشود و اگر یک اتم خنثی الکترون بیشتری به دست آورد، دارای بار خالص منفی میشود و به عنوان یک آنیونشناخته شدهاست. به سبب ناهمگونی بار الکتریکی خود، کاتیونها و آنیونها یکدیگر را به آسانی جذب و تشکیل ترکیبات یونی مانندنمک را ممکن میسازند. پلاسما از مواد گازی تشکیل شدهاست که بهطور کامل در دمای بالا یونیزه شدهاست.
واکنش اسید و بازویرایش
نوشتار اصلی: واکنش اسید و باز
هنگامی که هیدروژن برمید (HBr), در آب حل میشود اسید قوی هیدروبرومیک اسیدتشکیل میشود.
واکنش اسید و باز یک واکنش شیمیایی است که میان یک اسید و یک باز اتفاق میافتد. مفاهیم متعددی که تعاریف دیگری از مکانیزم واکنشهای درگیر و کاربرد آنها در حل مسائل وجود دارد. علیرغم تعدد تعاریف مختلف، اهمیت آنها در تجزیه و تحلیل هنگام سر و کار داشتن با واکنشهای اسید و باز در حالتهای گازی یا به خصوص مایع یا حتی در حالتهایی که به ندرت دیدهمیشوند، مشخص میشود. اولین مفاهیم دربارهٔ واکنشهای اسید و باز در حدود سال ۱۷۷۶ توسط آنتوان لاووازیه تنظیم شد.[۱۸]
براساس تعریف سوانت آرنیوس اسید مادهای است که در محلول آبی از هم جدا میشود و یون هیدروژن H+ (یک پروتون) آزاد میکند.[۱۹]
HA ![]() A− + H+
A− + H+
ثابت تعادل در اینگونه واکنشهای جداسازی، ثابت جداسازی نام دارد. پروتون آزاد شده با یک مولکول آب وارد واکنش میشود تا یکهیدرونیوم (یا اکسینیوم) یون H۳O+ بدهد. بعدها آرنیوس پیشنهاد کرد که این جداسازی را با نام واکنش اسید-باز شناخته شود.
HA + H۲O ![]() A− + H۳O+.
A− + H۳O+.
بر طبق نظریه اسید-باز برونستد-لوری اسید مادهای است که پروتون(H+) از دست میدهد و باز مادهای است که پروتون میگیرد. به عنوان نمونه در واکنش اسید استیک و آب، استیک اسید پروتون از دست داده و آب پروتون میگیرد پس استیک اسید، اسید و آب به عنوان باز عمل میکند.[۲۰][۲۱]طبق نظریهٔ لوییس مولکولی که بتواندجفت الکترون غیر پیوندی از مولکول دیگری دریافت کند اسید و مولکول دهنده جفت الکترون باز است. این نظریه نخستین بار توسط دانشمند مشهور آمریکایی گیلبرت لوویس و در سال ۱۹۲۳ ارائه شد.[۲۲]
اکسایش-کاهشویرایش
نوشتار اصلی: اکسایش-کاهش
دو بخش واکنش اکسایش و کاهش.
زنگ زدن، یک واکنش اکسیداسیون آهسته
اکسایش-کاهش نام کلی واکنشهای شیمیایی است که مایه تغییرعدد اکسایش اتمها میشوند. این فرایند میتواند دربرگیرنده واکنشهای سادهای همچون اکسایش کربن و تبدیل آن به کربن دیاکسید و کاهش کربن و تبدیل آن به متان یا واکنشهای پیچیدهای چون اکسایش قند در بدن انسان طی واکنشهای چند مرحلهای باشد. با کمی اغماض علمی میتوان این فرایند را انتقال یک یا چندالکترون از یک اتم، مولکول یا یون به یک اتم، مولکول یا یون دیگر دانست. در هر واکنش اکسایش و کاهش اتم یا مولکولی الکترون از دست میدهد (اکسایش) و اتم یا مولکولی دیگر الکترون جذب میکند (کاهش) مییابد. در چنین واکنشی مولکول دهنده اتم اکسیده شده و مولکول گیرنده کاهیده میشود. در واقع تعریف ابتدایی اکسایش واکنش یک ماده با اکسیژن و ترکیب شدن با آن بودهاست، اما با کشف الکترون اصطلاح اکسایش دقیقتر تعریف شد و کلیه واکنشهایی که طی آن مادهای الکترون از دست میدهد اکسایش نامیده شدند. اتم اکسیژن میتواند در چنین واکنشی شرکت داشته یا نداشته باشد. در اثر اکسایش عدد اکسایش معمولی یک اتم یا اتمهای یک مولکول در پی حذف الکترونها افزایش مییابد. برای نمونه آهن (II) میتواند به آهن (III) اکسید شود.
-Fe2+ → Fe3+ + e
تعادل شیمیاییویرایش
نوشتار اصلی: تعادل شیمیایی
تعادل شیمیایی به حالتی گفته میشود که در آن فعالیت شیمیایی و در نتیجه غلظت واکنشگرها و محصولات در واکنش شیمیایی با گذشت زمان تغییر نکند. معمولاً این تعادل در شرایطی حاصل میشود که سرعت واکنش رفت با برگشت برابر باشد. از دیدگاه ترمودینامیکی تغییرات انرژی آزاد گیبسواکنش در تعادل شیمیایی صفر است. کاهش سطح انرژی و افزایش انتروپی (بینظمی) آن را در دو جهت رفت (مستقیم) و برگشت (مع) بهطور همزمان پیش میبرند. در تعادلهای شیمیایی هیچ
یک ,شیمیایی ,میشود ,عنصر ,ماده ,اتم ,است که ,که در ,به عنوان ,از یک ,که به ,تعداد اتمهای موجود














درباره این سایت